1. Die Funktion der Brennstoffzelle
Die fossilen Brennstoffe wie Kohle, Erdgas und Erdöl gehören derzeit zu den wichtigsten Energieträgern. Das Erdgas hat eine
große Bedeutung als Heizgas in privaten Haushalten und in der Industrie. Erdöl ist dagegen die Grundlage für Benzin.
Außerdem werden die Stoffe für die Stromerzeugung benötigt. Allerdings prognostizieren verschiedene Studien,
dass spätestens bis zur Mitte des 21. Jahrhunderts die weltweit nutzbaren Vorkommen fossiler Brennstoffe erschöpft sein werden.
Deshalb muss nach alternativen Möglichkeiten der Energieversorgung gesucht werden.
Aufbau und Wirkungsweise einer Brennstoffzelle
 Brennstoffzellen sind galvanische Elemente, die chemisch gespeicherte Energie in elektrische Energie umwandeln.
Dies geschieht emissions- sowie geräuschfrei. Während chemische Energie in elektrische Energie umgewandelt wird,
entstehen Wärmeenergie, die je nach Bedarf genutzt werden kann und Wasser, welches in diesem Fall
das Abfallprodukt ist. Ideal arbeiten kann die Brennstoffzelle mit Wasserstoff, jedoch gibt es noch weitere Kraftstoffe wie z.B.
Methanol, Ethanol, Erdgas. Diese alternativen Stoffe können aber nicht direkt verarbeitet werden, sondern müssen zuvor
durch einen Reformer geleitet werden, der den gegebenen Kraftstoff in Wasserstoff und seine restlichen Bestandteile zerlegt.
Das Problem des Reformers besteht darin, dass bei der Zerlegung von Methanol bzw. Erdgas Kohlenstoff und Schwefel entstehen,
die in gewissen Zeitabständen entfernt und entsorgt werden müssen. Eine Brennstoffzelle ist wie folgt aufgebaut:
Es gibt zwei Elektroden, die Anode (positiv) und die Kathode (negativ), welche durch den protonenleitenden Elektrolyten
voneinander getrennt sind. An der Seite der Anode wird Wasserstoff zugeführt und auf der Seite der Kathode Sauerstoff.
Dem Wasserstoff wird durch die Anode ein negativ geladenes Elektron entzogen
Brennstoffzellen sind galvanische Elemente, die chemisch gespeicherte Energie in elektrische Energie umwandeln.
Dies geschieht emissions- sowie geräuschfrei. Während chemische Energie in elektrische Energie umgewandelt wird,
entstehen Wärmeenergie, die je nach Bedarf genutzt werden kann und Wasser, welches in diesem Fall
das Abfallprodukt ist. Ideal arbeiten kann die Brennstoffzelle mit Wasserstoff, jedoch gibt es noch weitere Kraftstoffe wie z.B.
Methanol, Ethanol, Erdgas. Diese alternativen Stoffe können aber nicht direkt verarbeitet werden, sondern müssen zuvor
durch einen Reformer geleitet werden, der den gegebenen Kraftstoff in Wasserstoff und seine restlichen Bestandteile zerlegt.
Das Problem des Reformers besteht darin, dass bei der Zerlegung von Methanol bzw. Erdgas Kohlenstoff und Schwefel entstehen,
die in gewissen Zeitabständen entfernt und entsorgt werden müssen. Eine Brennstoffzelle ist wie folgt aufgebaut:
Es gibt zwei Elektroden, die Anode (positiv) und die Kathode (negativ), welche durch den protonenleitenden Elektrolyten
voneinander getrennt sind. An der Seite der Anode wird Wasserstoff zugeführt und auf der Seite der Kathode Sauerstoff.
Dem Wasserstoff wird durch die Anode ein negativ geladenes Elektron entzogen
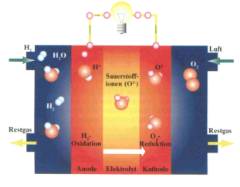
H2 ==>2H+ + 2e-
und dem Sauerstoff werden mit Hilfe der Kathode zwei Elektronen zugeführt.
1/2O2+2e-==>O2-
Dadurch entsteht im praktischen Sinne ein Stromfluss zwischen Anode und Kathode. Der Wasserstoff,
dem sein Elektron entzogen wurde, besteht nun mehr aus Protonen, welche durch den protonenleitenden
Elektrolyten zum Sauerstoffion (O2-) gelangen. Dadurch kommt es zu einer sogenannten „kalten Verbrennung“.
Als Produkt dieser Verbrennung entsteht lediglich Wasser (H2O(g)). Brennstoffzellen erzeugen eine Spannung
von etwa einem Volt und eine Stromdichte von einem Ampere pro cm². Bei der Umsetzung des Wasserstoffs entsteht
des weiteren Wärme, welche dann anderwärtig genutzt werden kann.
 Brennstoffzellen sind galvanische Elemente, die chemisch gespeicherte Energie in elektrische Energie umwandeln.
Dies geschieht emissions- sowie geräuschfrei. Während chemische Energie in elektrische Energie umgewandelt wird,
entstehen Wärmeenergie, die je nach Bedarf genutzt werden kann und Wasser, welches in diesem Fall
das Abfallprodukt ist. Ideal arbeiten kann die Brennstoffzelle mit Wasserstoff, jedoch gibt es noch weitere Kraftstoffe wie z.B.
Methanol, Ethanol, Erdgas. Diese alternativen Stoffe können aber nicht direkt verarbeitet werden, sondern müssen zuvor
durch einen Reformer geleitet werden, der den gegebenen Kraftstoff in Wasserstoff und seine restlichen Bestandteile zerlegt.
Das Problem des Reformers besteht darin, dass bei der Zerlegung von Methanol bzw. Erdgas Kohlenstoff und Schwefel entstehen,
die in gewissen Zeitabständen entfernt und entsorgt werden müssen. Eine Brennstoffzelle ist wie folgt aufgebaut:
Es gibt zwei Elektroden, die Anode (positiv) und die Kathode (negativ), welche durch den protonenleitenden Elektrolyten
voneinander getrennt sind. An der Seite der Anode wird Wasserstoff zugeführt und auf der Seite der Kathode Sauerstoff.
Dem Wasserstoff wird durch die Anode ein negativ geladenes Elektron entzogen
Brennstoffzellen sind galvanische Elemente, die chemisch gespeicherte Energie in elektrische Energie umwandeln.
Dies geschieht emissions- sowie geräuschfrei. Während chemische Energie in elektrische Energie umgewandelt wird,
entstehen Wärmeenergie, die je nach Bedarf genutzt werden kann und Wasser, welches in diesem Fall
das Abfallprodukt ist. Ideal arbeiten kann die Brennstoffzelle mit Wasserstoff, jedoch gibt es noch weitere Kraftstoffe wie z.B.
Methanol, Ethanol, Erdgas. Diese alternativen Stoffe können aber nicht direkt verarbeitet werden, sondern müssen zuvor
durch einen Reformer geleitet werden, der den gegebenen Kraftstoff in Wasserstoff und seine restlichen Bestandteile zerlegt.
Das Problem des Reformers besteht darin, dass bei der Zerlegung von Methanol bzw. Erdgas Kohlenstoff und Schwefel entstehen,
die in gewissen Zeitabständen entfernt und entsorgt werden müssen. Eine Brennstoffzelle ist wie folgt aufgebaut:
Es gibt zwei Elektroden, die Anode (positiv) und die Kathode (negativ), welche durch den protonenleitenden Elektrolyten
voneinander getrennt sind. An der Seite der Anode wird Wasserstoff zugeführt und auf der Seite der Kathode Sauerstoff.
Dem Wasserstoff wird durch die Anode ein negativ geladenes Elektron entzogen