Der Hochofenprozess wird genutzt um aus Eisenerz das begehrte Eisen zu gewinnen. Mit Hilfe dieser Technik können aber auch andere Metalle wie Kupfer oder Silicium gewonnen werden. Die Geschichte der Eisengewinnung reicht bis zu 2000 Jahre v. Chr. zurück. Allesdings war die Ausbeute an Roheisen in dieser Zeit noch nicht besonders hoch und belief sich auf wenige Kilogramm. Die Techniken zur Eisengewinnung wurden zwar mit der Zeit weiterentwickelt, sodass man sagen kann das eine Eisenhütte um 18hundert täglich bis zu einer viertel Tonne Eisen produzierte, aber der große Durchbruch wurde erst mit der Industriealisierung vollbracht. Der immer weiter steigende Bedarf an Eisen und Stahl führte dazu das auch immer neuere großindustrielle Anlagen errichtet wurden, welche mehr Eisen produzieren konnten aber auch effizienter arbeiteten und weniger Kohle verbrauchten. Außerdem wurde es erst mit der Eisenbahn möglich, die Hüttenwerke mit den großen Mengen an Eisenerz, Kohle und anderen Rohstoffen zu versorgen um größere Mengen an Eisenerz zu produzieren. |
|
Die Chemische Grundlage Der Hochofenprozess ist ein Prozess, welcher sich aus mehreren Redoxreaktionen zusammensetzt. Damit aber die eigentlichen Reaktionen zur Eisengewinnung ablaufen können, müssen erst die sogenannten Reduktionsgase im Hochofen hergestellt werden. Dies geschieht durch die Verbrennung des von in der Kohle vorhandenen Kohlenstoffs. Die Gleichungen dafür lauten: |
|
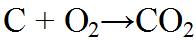 |
Die Verbrennung von Kohlenstoff ist eine stark exotherme Reaktion und liefert die notwendige Energie um den Hochofen auf die benötigte Temperatur von ca.2000 °C zu erhitzen. |
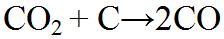 |
Diese Reaktion ist die sogenannte Boudouard Reaktion. Sie ist eine endotherme Reaktion und läuft nur bei sehr hohen Temperaturen ab. |
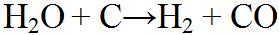 |
Der im Hochofen befindliche Wasserdampf wird ebenfalls bei hoher Temperatur aufgespalten wobei Wassersoff und Kohlenstoffmonoxid entsteht. |
Diese beiden Stoffe (Wasserstoff und Kohlenmonoxid) dienen als Reduktionsmittel um in den weiteren Reaktionen das Eisen zu gewinnen. Dieser Prozess läuft in der sogenannten Reduktionszone ab, wo Temperaturen zwischen 400 und 900 °C herschen. Die in den folgenden Reaktionen entstehenden Reaktionsprodukte H2O und CO2 werden, solange sie sich noch in den nötigen Temperaturbereich befinden, wieder Aufgespalten wodurch wieder die Reduktionsgase entstehen, welche wiederum für die Reduzierung des Eisenerzes verbraucht werden. Die Gleichungen dazu lauten: |
|
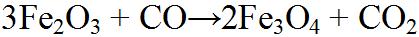 |
Hier wird mit Hilfe von dem Reduktionsgas Kohlenmonoxid über 3 Teilschritte, das Eisenerz zu Eisen reduziert. |
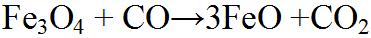 |
|
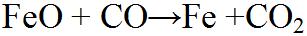 |
|
| Diese 3 Gleichungen stellen den Weg zum Eisen mit Hilfe des Reduktionsmittels Wasserstoff dar. Hier wird der Wasserstoff zu Wasser Oxidiert. | 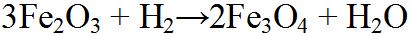 |
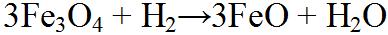 |
|
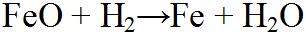 |
|
| Im weiteren Verlauf des Hochofenprozesses sinken die Materialien immer weiter nach unten wo auch die Temperaturen höher sind und das Eisen zum Schmelzen gebracht wird. Dieses flüssige Eisen ist schwerer als die, als Nebenprodukt entstehende die Schlacke und sinkt deshalb zum Grund des Hochofens wo es entnommen werden kann. | |