|
Reaktionen bezeichnet man alle Prozesse bei dehnen chemische in elektrische(galvanische Prozesse) oder elektrische in chemische Energie(elektrolytische Prozesse) umgewandelt werden. Dabei bezeichnet man die galvanischen Prozesse als freiwillig ablaufende und die elektrlytischen Prozesse als erzwungene Reaktionen. |
|
|
Geschichtliches
|
Bedeutung von Galvanischen Prozessen: - Korrosion (Rost) - mobile elektrische Energie (Batterien, Akkumulatoren, Brennstoffzelle) - elektrochemische Analysemethoden Bedeutung von Elektolytischen Prozessen: - verschiedene Synthesen (z.B. Kupfer, Chlor, Aluminium) - Galvanisieren(Korrosionsschutz) - elektrochemische Analysemethoden |
| Beispiel | |
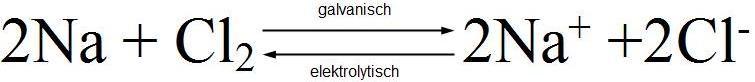 |
|
Elektrochemische Reaktionen sind prinzipiell umkehrbar. Dabei beschreibt das Elektronenpotenzial die Energie, die entweder frei wird oder die notig ist um die Reaktion ablaufen zu lassen. |
|
Die Brennstoffzelle als Beispiel einer Galvanischen Zelle |
|
zurück zum Seitenanfang
zurück zur Startseite