Verbrennung von Wasserstoff zu H2O |
|
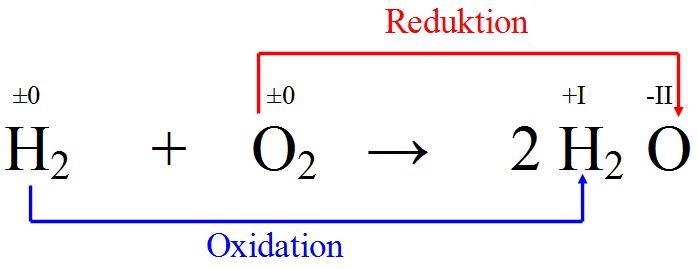 |
Hier agiert der Wasserstoff als Reduktionsmittel, da er Elektronen abgibt und der Sauerstoff als Oxidationsmittel, da er Elektronen aufnimmt. Diese Reaktion ist exotherm und Grundlage der Brennstoffzelle. |
Verbrennung von Magnesium zu Magnesiumoxid |
|
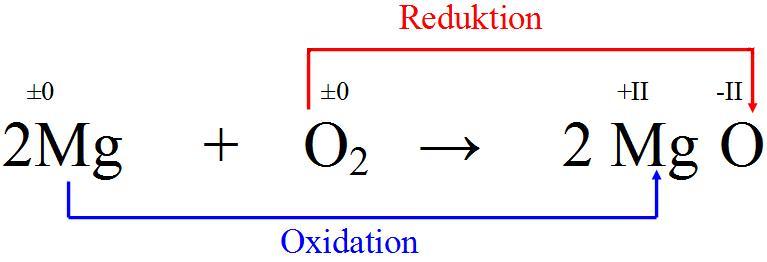 |
Hier agiert ebenfalls der Sauerstoff als Oxidationsmittel und das Magnesium als Reduktionsmittel. Diese Verbrennung ist so stark exotherm das Magnesium, wenn es erst einmal brennt, auch unter Wasser weiterbrennt. |
Reduzierung von Eisenoxid zu Eisen |
|
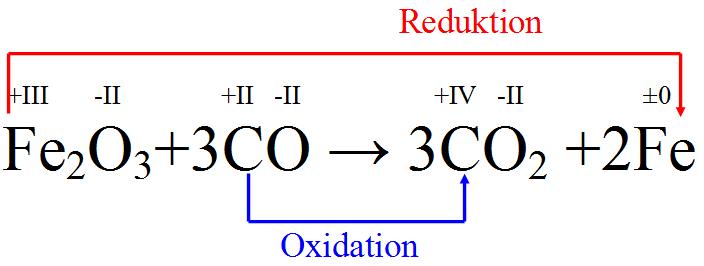 |
Hier fungiert der Kohlenstoff als Reduktionsmittel und das Eisen als Oxidationsmittel. Diese Reaktion läuft unter anderem im Hochofenprozess ab. |
Teilreaktion bei der Natriumcloridsynthese |
|
| Löst man Natriumchlorid in Wasser, entstehen positiv geladene Natriumionen und negativ geladene Chlorid-Ionen. Dabei agiert das Natrium als Reduktionsmittel und das Chlor als Oxidationsmittel. | |